瓊脂糖凝膠電(diàn)泳實驗常見問題分析
發布時(shí)間(jiān):
2024-01-15 15:07
瓊脂糖凝膠電(diàn)泳實驗常見問題分析
瓊脂糖凝膠電(diàn)泳已經成為(wèi)一種分析鑒定重組DNA分子及蛋白質與核酸相互作(zuò)用的重要實驗手段,也是分子生(shēng)物學研究的重要方法,常用于DNA分型、鑒定DNA、RNA分子混合物、DNA核苷酸序列分析等技(jì)術(shù),以瓊脂凝膠作(zuò)為(wèi)支持物,利用 DNA 分子在電(diàn)場(chǎng)中的電(diàn)荷效應和(hé)分子篩效應,達到分離混合物的目的。
現在我們一起了解一下瓊脂糖凝膠電(diàn)泳的工作(zuò)原理(lǐ)和(hé)實驗中常見的問題和(hé)解決方法。
- 什麽是電(diàn)泳?
電(diàn)泳是一種利用電(diàn)流根據DNA、RNA或蛋白質的物理(lǐ)特性(如大(dà)小(xiǎo)和(hé)電(diàn)荷)來(lái)分離它們的技(jì)術(shù)。
- 什麽是瓊脂糖?
瓊脂糖是一種線性多(duō)糖聚合物,從紅色海藻産物瓊脂中提取而來(lái)。将瓊脂糖粉末加熱到熔點後冷切凝固便會(huì)形成良好的電(diàn)泳介質,其密度由瓊脂糖的濃度決定。
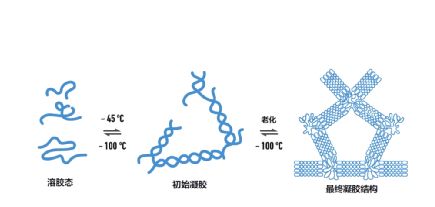
- 什麽是瓊脂糖凝膠電(diàn)泳?
瓊脂糖凝膠電(diàn)泳是一種電(diàn)泳形式,用于根據核酸(DNA或RNA)片段的大(dà)小(xiǎo)進行(xíng)分離。當施加電(diàn)流時(shí),帶負電(diàn)的DNA/RNA通(tōng)過瓊脂糖凝膠的孔隙向凝膠帶正電(diàn)的一端遷移,較小(xiǎo)的片段遷移較快。由此産生(shēng)的條帶可(kě)以用紫外線(UV)光來(lái)觀察。
- 瓊脂糖凝膠電(diàn)泳實驗技(jì)巧和(hé)注意事項
- 瓊脂糖凝膠溶液配制(zhì)時(shí)總液體(tǐ)量不宜超過錐型瓶50%容量。否則會(huì)溢出。
- 加熱過程中要不時(shí)搖動,使附于瓶壁上(shàng)的瓊脂糖顆粒進入溶液。加熱時(shí)應蓋上(shàng)封口膜,以減少(shǎo)水(shuǐ)份蒸發。
- 注意不要損傷梳底部的凝膠。一個(gè)是在拔梳子的時(shí)候,一個(gè)是在加樣時(shí)。
- 凝膠濃度越低(dī)(非常脆弱且難以處理(lǐ)),分辨的片段越大(dà);凝膠濃度越高(gāo)(很(hěn)脆且可(kě)能凝固不均勻),分辨的片段越小(xiǎo)。所以在制(zhì)膠的時(shí)候要特别注意。
- 瓊脂糖凝膠電(diàn)泳常見問題與異常分析
Q1:為(wèi)什麽marker條帶非常模糊,無法辨别具體(tǐ)條帶?
A1:出現上(shàng)述情況,可(kě)能有(yǒu)以下幾個(gè)原因:
1. marker條帶出現了降解。請(qǐng)确保在使用過程中避免核酸酶污染;
2. 電(diàn)泳緩沖液陳舊(jiù)。電(diàn)泳緩沖液多(duō)次使用後,離子濃度降低(dī),pH值上(shàng)升,緩沖能力減弱,從而影(yǐng)響電(diàn)泳效果,建議經常更換電(diàn)泳緩沖液;
3. 電(diàn)泳條件不合适。電(diàn)泳時(shí)電(diàn)壓應不超過20V/cm,溫度應低(dī)于30℃;
4. marker上(shàng)樣量過多(duō)。請(qǐng)根據說明(míng)書(shū)選用合适上(shàng)樣量;
5. 凝膠質量不好。建議使用質量較好的瓊脂糖;此外,凝膠凝固不均勻也會(huì)導緻條帶模糊。
Q2:為(wèi)什麽marker條帶出現不規則的條帶(如啞鈴狀等)?
A2:出現上(shàng)述情況,多(duō)與以下幾個(gè)原因有(yǒu)關:
1. 電(diàn)泳緩沖液陳舊(jiù)。老化的電(diàn)泳緩沖液離子濃度降低(dī),pH值上(shàng)升,緩沖能力減弱,從而影(yǐng)響電(diàn)泳效果,建議經常更換電(diàn)泳緩沖液;
2. 電(diàn)泳條件不合适。電(diàn)泳時(shí)電(diàn)壓應不超過20V/cm,電(diàn)壓太高(gāo)可(kě)能也會(huì)導緻marker條帶出現不規則現象。此外,凝膠質量差以及凝膠冷卻時(shí)凝固不均勻也會(huì)導緻該現象出現。
Q3:為(wèi)什麽marker條帶非常弱或者根本沒有(yǒu)條帶?
A3:出現上(shàng)述情況可(kě)能是:
1. marker上(shàng)樣量較低(dī),可(kě)适當增加上(shàng)樣量;
2. 凝膠質量較差或凝膠凝固不均勻也會(huì)導緻電(diàn)泳條帶弱或根本沒有(yǒu)條帶;
3. 電(diàn)泳時(shí)間(jiān)過長導緻marker條帶跑出凝膠,可(kě)縮短(duǎn)電(diàn)泳時(shí)間(jiān),降低(dī)電(diàn)壓,增加凝膠濃度。
Q4:為(wèi)什麽marker缺帶?
A4:對于含有(yǒu)較小(xiǎo)片段的marker,如果出現缺帶現象,可(kě)能是因為(wèi):
1. 小(xiǎo)條帶跑出凝膠或分子量大(dà)小(xiǎo)非常相近的條帶不易辨認所緻,可(kě)适當縮短(duǎn)電(diàn)泳時(shí)間(jiān),降低(dī)電(diàn)壓,同時(shí)增加凝膠濃度;
2. 凝膠中染料含量過低(dī),導緻大(dà)片段結合染料量太少(shǎo)或沒有(yǒu),在藍(lán)光儀下亮度太低(dī),可(kě)适當增加染料用量。
Q5:加樣孔出現熒光
1. 原因分析:大(dà)片段DNA的滞留;
2. 解決方法:樣品出現溢出,應該通(tōng)過降低(dī)模闆量或濃度來(lái)處理(lǐ);
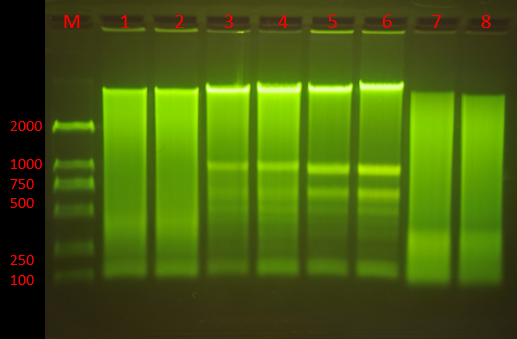
Q6:條帶模糊或彌散
1. 原因分析:
(1)DNA發生(shēng)降解;
(2)電(diàn)泳緩沖液陳舊(jiù);
(3)電(diàn)泳條件不合适;
(4)核酸樣品純度差,含有(yǒu)DNA結合蛋白或高(gāo)濃度的鹽分;
(5)染色時(shí)間(jiān)過長或拍照前放置過久,DNA條帶彌散;
(6)PCR非特異性的擴增;
(7)加樣時(shí)操作(zuò)不當,樣品飄出樣孔;
2. 解決方法:
(1)更換緩沖液;
(2)根據凝膠大(dà)小(xiǎo)和(hé)電(diàn)泳緩沖液類型,使用适當的電(diàn)壓進行(xíng)電(diàn)泳;
(4)電(diàn)泳結束後及時(shí)觀察、拍照;
(5)DNA Maker進行(xíng)對照,校(xiào)正是否為(wèi)電(diàn)泳體(tǐ)系的問題;
(6)使用特異性較高(gāo)的引物;
(7)降低(dī)電(diàn)泳時(shí)的上(shàng)樣量,并小(xiǎo)心謹慎操作(zuò)實驗;
Q7:無條帶或者弱條帶
- 原因分析:
(1)DNA的上(shàng)樣量不夠;
(2)DNA發生(shēng)降解;
2. 解決方法:
(1)增加上(shàng)樣量;
(2)防止DNA降解,如:避免反複凍融樣品、避免核酸酶的污染。
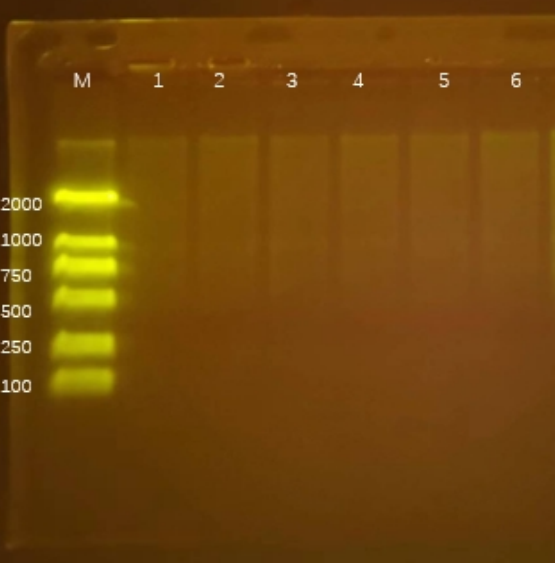
Q8:DNA Marker降解
- 原因分析:
- 核酸酶污染;
- 保存不當;
- 解決方法:
- 每次吸取時(shí)更換滅菌槍頭,勿将電(diàn)泳緩沖液帶入管中、用後密閉4°C保存;
(2)4°C 或-20°C保存,避免多(duō)次反複凍融、不可(kě)加熱;
Q9:DNA Marker無正确分離
- 原因分析:
- 瓊脂糖質量差;
- 電(diàn)泳緩沖液多(duō)次使用後失效;
- 解決方法:
- 使用質量可(kě)靠的瓊脂糖制(zhì)膠;
- 更換緩沖液;
Q10:條帶缺失
- 原因分析:
- DNA條帶分子量過大(dà);
- 分子量接近的DNA條帶沒有(yǒu)分開(kāi);
- 電(diàn)泳緩沖液使用不當;
- 電(diàn)泳時(shí)間(jiān)過長或電(diàn)壓過高(gāo),DNA走出凝膠
- 電(diàn)極插反,DNA走出凝膠
- 解決方法:
(1)使用脈沖凝膠電(diàn)泳;
(2)選擇适當的凝膠濃度進行(xíng)電(diàn)泳;
(3)SD和(hé)TBE緩沖液适于分析較小(xiǎo)分子量的核酸片段,大(dà)片段分子不能完全分離;TAE緩沖液不适于分離很(hěn)小(xiǎo)的核酸片段;
(4)縮短(duǎn)電(diàn)泳時(shí)間(jiān),調整電(diàn)壓;
(5)正确連接電(diàn)極方向;
Q11:條帶大(dà)小(xiǎo)不正确
- 原因分析:
- 核酸降解或形成聚合物;
(2)λ DNA酶切Marker的cos位點複性;
(3)相同分子量的核酸片段由于結構或序列的差異而有(yǒu)不同的遷移率;
(4)梳子變形,點樣孔不在同一水(shuǐ)平線上(shàng);
2. 解決方法:
(1)加熱處理(lǐ)或重新制(zhì)備樣品;
(2)電(diàn)泳前65°C加熱5分鍾,冰上(shàng)冷卻5分鍾以後再上(shàng)樣;
(3)判斷核酸分子是否有(yǒu)特殊結構,如缺口、超螺旋、二聚體(tǐ)等;富含AT堿基的DNA遷移率比同分子量富含GC堿基的核酸片段慢;
(4)使用完好的梳子制(zhì)膠。
Q12:小(xiǎo)片段擴散,條帶模糊,粗
- 原因分析:
- 錯誤選擇了低(dī)濃度凝膠,觀察大(dà)片段用低(dī)濃度凝膠,觀察小(xiǎo)片段要用高(gāo)濃度;
- 瓊脂糖質量不好,質量不好的瓊脂糖分離小(xiǎo)片段容易擴散,即使是使用高(gāo)濃度凝膠;
- 選擇了不合适的電(diàn)泳緩沖液 ;
- 解決方法:
- 比如觀察100bp的小(xiǎo)片段用2%凝膠跑電(diàn)泳;
- 換用質量好的瓊脂糖;
- SD和(hé)TBE緩沖液适于分析較小(xiǎo)分子量的核酸片段,大(dà)片段分子不能完全分離;TAE緩沖液不适于分離很(hěn)小(xiǎo)的核酸片段。
Q13:條帶偏移扭曲
- 原因分析:
- 瓊脂糖凝膠配置出現問題;
- 凝膠未完全凝固;
- 凝膠在電(diàn)泳槽中位置擺放偏移;
- 解決辦法:
- 應準确配置瓊脂糖凝膠,并充分進行(xíng)凝固;
- 應固定好凝膠在電(diàn)泳槽中的位置,避免電(diàn)泳過程中出現偏移;
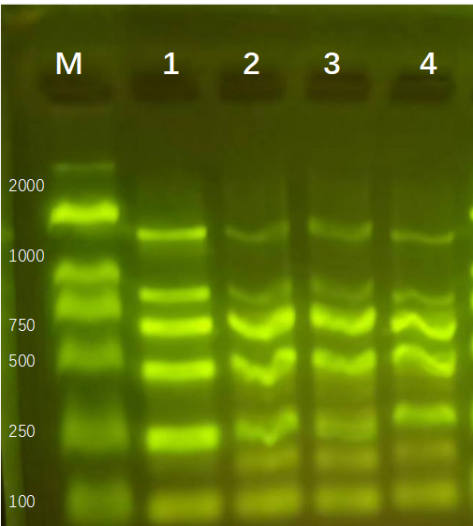
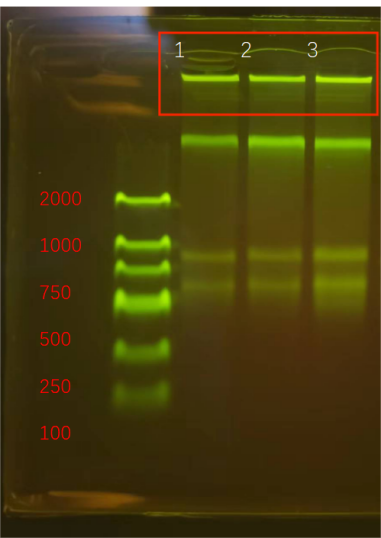
上(shàng)海領駿自主研發的磁珠法核酸提取試劑,可(kě)以提取高(gāo)質量的核酸DNA/RNA,進行(xíng)瓊脂糖凝膠電(diàn)泳,能夠得(de)到清晰、明(míng)亮、完整的條帶,并且操作(zuò)簡單快速,整個(gè)流程基本分為(wèi)(裂解結合、洗滌、幹燥、洗脫),大(dà)多(duō)數(shù)10-30min內(nèi)即可(kě)完成。可(kě)針對血液、血清/血漿、唾液、細菌、真菌、拭子、糞便、動植物組織、中草藥、石蠟包埋組織、PCR産物、測序反應産物等樣本,分離純化高(gāo)質量基因組DNA/RNA、cfDNA、ctDNA或病毒核酸。
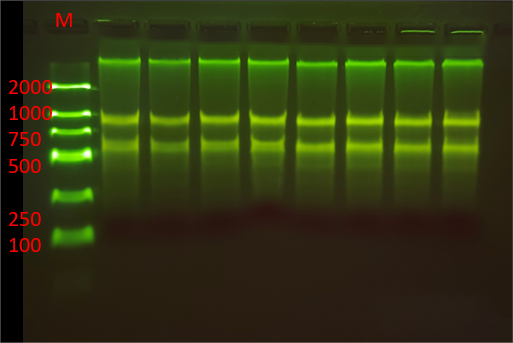
圖 新鮮yan葉DNA/RNA提取電(diàn)泳圖
歡迎咨詢、采購!
推薦新聞